Denne teksten bygger videre på teksten vår “Hydrogen”, som tar for seg hvorfor det er ønskelig å bruke hydrogen som energibærer og hvordan man fremstiller hydrogen. Du kan lese teksten her.
Dersom den fremstilte gassen lagres, kan den senere omsettes tilbake til elektrisk energi. På denne måten kan for eksempel overskuddsenergi fra solceller, vindmøller og andre fornybare energikilder lagres som hydrogen, og benyttes senere når sol- og vindenergi ikke er like tilgjengelig. I denne teksten kommer vi til å se på hvordan hydrogengassen kan lagres og senere brukes i en brenselcelle.
Aktuelle lagringsmetoder for hydrogen
Illustrasjon: UngEnergi
For at man skal kunne bruke hydrogenets energi ved en senere anledning, må man ha et sted å lagre gassen. Men på grunn av at hydrogen har så liten massetetthet, kan dette være utfordrende. Nedenfor har vi satt sammen en liste av noen aktuelle måter man kan lagre hydrogengass på:
- Den mest vanlige og enkleste måten i dag er å lagre hydrogenet i tanker med svært høyt trykk. På denne måten kan vi oppnå en høyere energitetthetInnhold av energi pr masseenhet eller volumenhet, for eksempel kg eller liter. J/kg og J/l er eksempler, men typiske enheter for batterier er kWh/kg eller kWh/l. og kan lagre mer energi i mindre volum. Dette er en moden teknologi, det vil si at den er klar til å brukes på større skala, men prosessen er energikrevende.
- En annen måte er å kjøle hydrogenet ned til svært lave temperaturer slik at hydrogengassen blir flytende, det vil si kaldere enn 250 kuldegrader. Gjør vi dette vil hydrogenmolekylene bevege seg mindre, og ta opp mindre plass. Problemer med denne metoden er at tankene enten må være svært godt isolerte, ha store kjølesystemer, unngå at luft slipper inn i tanken under fylling og at den er svært energikrevende. Teknologien for nedkjøling er moden, men mest egnet til større systemer.
- Det er også mulig å lagre hydrogen i form av enkle hydrogenbærende kjemikalier, for eksempel etanol, metan eller ammoniakk. Disse kan i ettertid spaltes for å benytte hydrogenet (som vi så med dampreformering av metan), eller brukes direkte. Bruker man denne måten å lagre hydrogen på, kan man oppnå enda større tetthet av hydrogen. En ulempe med denne metoden er at man taper energi og kan slippe ut klimagasser når man tar ut hydrogenet.
- Noen metaller og legeringer har evnen til å absorbere og frigi hydrogengass gjennom dannelsen av metallhydrider. Ved lagring av hydrogen vil hydrogenmolekylene først splittes i dets to hydrogenatomer på overflaten av metallet og deretter transporteres inn i metallstrukturen. Vi kan sammenligne dette med måten en svamp absorberer vann. For de mest lovende legeringene kan man faktisk pakke hydrogen tettere sammen enn tilfellet er med flytende hydrogen. Fordelen med å lagre hydrogen på denne måten er at det gir en kompakt og svært sikker lagring, uten behov for trykktanker eller kraftig nedkjøling. Selv om denne teknologien har klare fordeler fremfor de andre, så har den enda ikke nådd et kommersielt nivå.
Brenselcellen
Energien vi nå har lagret i form av hydrogen kan brukes på flere måter. Et eksempel er brenselcellen, et galvanisk elementEt type batteri hvor kjemisk energi omdannes til elektrisk energi som består av to elektroder (en anode og en katode) senket ned i en elektrolytt. Elektrodene er koblet sammen med en leder slik at det kan gå strøm gjennom. som omdanner kjemisk energiEnergi som finnes i bindingene mellom atomene i et stoff, og som blir frigitt ved fullstendig forbrenning. Eksempler er bensin og mat. Dessuten kan batterier omforme kjemisk energi til elektrisk energi. til elektrisk energi med vann som eneste utgangsstoff. Brenselcellen vi skal se nærmere på PEM-cellen og forklare (forenklet) hvordan den fungerer.
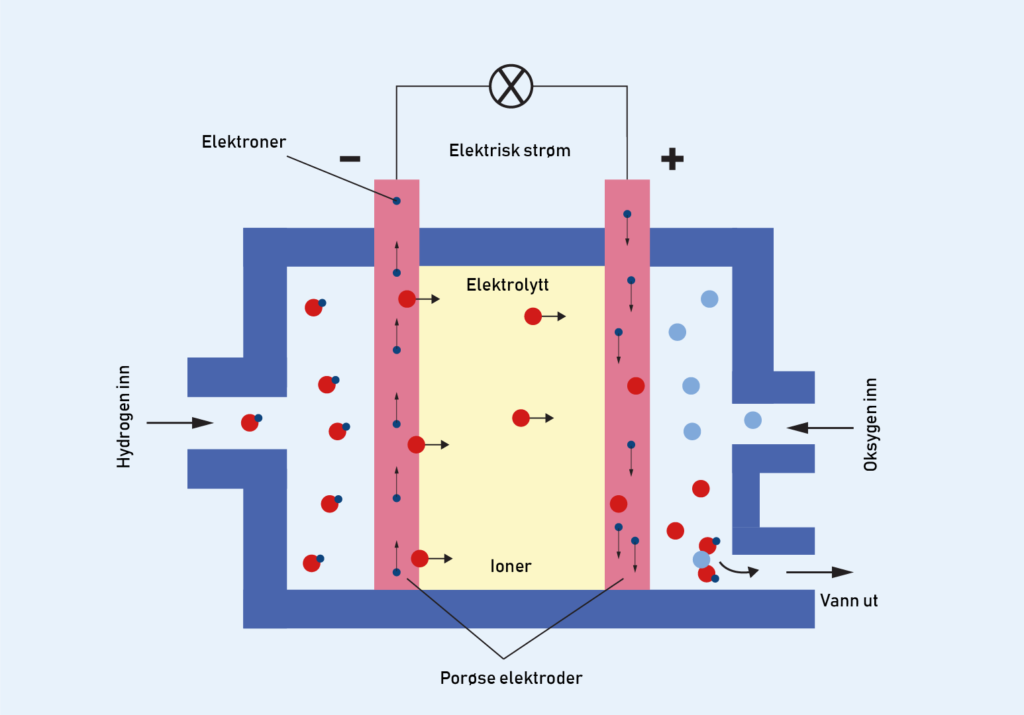
En membran, som kun kan slippe gjennom positivt ladde hydrogenioner (protoner), skiller \(\text{H}_2\)-gass på den ene siden fra \(\text{O}_2\)-gass på den andre siden. På hver side av membranen har man en fast elektrodeEn elektrode er et elektrisk tilkoblingspunkt. Kan ses på som en «stav» som fører elektroner slik at det blir dannet elektrisk strøm. Når du har to elektroder med spenning mellom dem kalles den negative katode og positive anode. som består av et tynt lag med katalysatorEt stoff som øker reaksjonshastigheten ved at det senker reaksjonsenergien til stoffene. hvor reaksjonene skjer, et transportlag som fordeler gassen jevnt utover, og en plate hvor gassen føres inn gjennom. Denne platen fungerer også som mekanisk støtte for de tynne lagene og kan ha innebygde kjøle- og fuktekanaler. De to sidene er koblet sammen av en elektrisk ledning som transporterer elektroner.
Hydrogen- og oksygengassen ønsker gjerne å gå sammen for å oppfylle oktettregelen og danne vann, \(\text{H}_2\text{O}\), men de er atskilt av denne membranen som bare leder protoner. For å kunne reagere, kvitter hvert av hydrogenatomene i hydrogengassen seg for sitt ene elektron og blir et \(\text{H}^+\)-ion (proton). Vi vet fra før at hydrogenatomet bare består av ett elektron, og ett proton. Nå som hydrogenatomene har kvittet seg for elektroner, står de bare igjen som protoner, som kan transporteres gjennom membranen. Denne prosessen kan forklares med reaksjonslikningen nedenfor. Hvis du har lært om redoksreaksjoner, kan du kanskje gjenkjenne at dette er en oksidasjon. Den foregår på elektrodenEn elektrode er et elektrisk tilkoblingspunkt. Kan ses på som en «stav» som fører elektroner slik at det blir dannet elektrisk strøm. Når du har to elektroder med spenning mellom dem kalles den negative katode og positive anode. vi kaller for anoden.
$$\text{2H}_2 \enspace \to \enspace \text{2H}^+ + \text{2e}^-$$
Ettersom hydrogen er adskilt fra oksygen må protonet transporteres gjennom membranen og elektronene gjennom ledningen til den andre siden for å kunne fullføre reaksjonen med tilført oksygengass. Her kan endelig hydrogenatomene binde seg til oksygenatomene og danne vann. Dette kan vi forklare med reaksjonslikningen nedenfor. Igjen, hvis du har lært om redoksreaksjoner, ser du kanskje at dette er en reduksjon.
$$\text{O}_2 + \text{4H}^+ + \text{4e}^- \enspace \to \enspace \text{2H}_2\text{O} $$
Disse to reaksjonslikningene kan kombineres til å bli reaksjonslikningen nedenfor. Hvis du ikke har lært om redoksreaksjoner, kan hele prosessen som skjer i brenselcellen likevel forklares enkelt med denne reaksjonslikningen. Her markerer “(l)” og “(g)” hvilken aggregattilstandDe ulike tilstandene et stoff kan være i. Når vi skriver (s), (l) eller (g) i kjemiske formler, refererer vi til aggregattilstanden til stoffet, som er henholdsvis fast, flytende eller gass. stoffene er i.
$$\text{2H}_2\text{(g)} + \text{O}_2\text{(g)} \enspace \to \enspace \text{2H}_2\text{O(l)} $$
Det er når elektronene går gjennom ledningen at vi får strøm, som vi kan utnytte i form av elektrisk energi til for eksempel å drive den elektriske motoren i en hydrogenbil. Avfallsstoffet fra reaksjonen er H2O, altså bare rent vann.
Fordeler og ulemper med brenselcellen
Brenselcellen har flere fordeler som gjør den bedre enn andre måter å produsere elektrisk energi på. Den har bare rent vann som avfallsstoff, så den skaper ingen lokale utslipp. Brenselcellen kan levere energi uten å måtte “lades opp”, slik som batterier, så lenge brenselet (hydrogenet) og oksidanten (oksygenet) blir tilført kontinuerlig. Den har ingen bevegelige deler og er bygd på en enkel måte, noe som gjør at det er få ting som kan gå i stykker mekanisk. Brenselcellen har også høy virkningsgradVirkningsgraden til et system er definert som \( \frac{\text{nyttbar energi}}{\text{tilført energi}} \) og betegnes ofte med den greske bokstaven \( \eta \)., som betyr at det er lite av den kjemiske energien i utgangsstoffene som går tapt under omgjøringen til elektrisk energi.
Det er likevel noen ulemper med brenselcellen. Membranen er svært tynn og er avhengig av riktig vannmengde for å kunne lede protoner godt. Den lager et svakt surt miljø og man må derfor bruke sjeldne metaller, ofte platina, til å lage katalysatorene. Både katalysatorene og membranen er komponenter som er følsomme for forurensninger og kan som kan gå i stykker. Dette gjør at denne typen brenselceller er relativt dyr og har begrenset levetid.
Hydrogenet kan også lagres og brukes i personbiler ved bruk av liknende teknologier som de denne teksten tok for seg. Du kan lese mer om hydrogenbiler her (UngEnergi.no).

 Denne artikkelen skrevet av UngEnergi er lisensiert under en
Denne artikkelen skrevet av UngEnergi er lisensiert under en