Hydrogen kan være nøkkelen til nullutslippssamfunnet, sies det. Energibæreren omtales som en viktig del av løsningen på energiutfordringene fremtiden kommer til å by på. Allerede nå tas hydrogen i bruk i transport-, varme- og kraftsystemer i hele verden. Men hvorfor bruker vi akkurat hydrogen og ikke et annet stoff, og hvor får vi alt hydrogenet fra?
UngEnergis video om hydrogen
Film: UngEnergiSe også: Hydrogenbil og brenselcelle (UngEnergi.no)
Hvorfor vil man bruke hydrogen som energibærer?

Hydrogen kan bidra til reduserte \(\text{CO}_2\)-utslipp i flere sektorer og forbedret luftkvalitet dersom man begynner å bruke hydrogen som energibærer. Forbedret luftkvalitet er spesielt viktig i verdens storbyer som plages av mye forurensning. Nedenfor har vi satt sammen en liste over noen sektorer som kan ha fordel av å bytte til hydrogen:
- Transport: Hydrogen vil være viktig i dekarboniseringen av transportsektoren som frakter tungt eller langt, og trenger større energimengder enn det som er optimalt for batterier. Dette gjør hydrogen til et godt fornybart alternativ til fossile energikilder.
- Energilagring: Vi kan ikke kontrollere hvor mye elektrisitet som produseres av energikilder som vind og sol. Overskuddet fra slike kilder kan brukes til å framstille hydrogen slik at energien kan lagres og brukes senere når man trenger mer strøm. Energien kan også lagres i batterier, men dagens batterier sliter blant annet med at de mister lagring over tid, noe som ikke passer når man skal lagre fornybar energi til årstider hvor forbruket er høyt. Batterier er også tungvinte å transportere fra steder hvor man har fornybar kraftproduksjon på grunn av sin vekt. Du kan lese mer om lagring av hydrogen her (UngEnergi.no).
- Varme: Hydrogen kan erstatte bruken av naturgass til oppvarming og komfyrer i land som har et utviklet gassrørnett.
- Kraftproduksjon: en stor andel av kraftproduksjonen i de fleste land baseres i dag på fossile brensler. Hvis disse erstattes med hydrogen, vil en vesentlig del av dagens CO2-utslipp elimineres og luftkvaliteten forbedres.
Hvorfor har hydrogen energi?
Atomer har protoner og nøytroner i kjernen og elektroner som sirkler i baner rundt den. Når vi ser for oss et atom, bruker vi ofte en forenklet atommodell vi kaller skallmodellen eller Bohrs atommodell. Her ser man for seg at atomene har ett eller flere skall rundt kjernen. Det innerste skallet har aldri mer enn to elektroner. De andre skallene kan ha opptil åtte elektroner. Ifølge oktettregelenRundt atomkjernene svever elektronene i lag (skall). Det innerste skallet kan kun inneholde to elektroner, mens resten inneholder åtte. Oktettregelen sier at ethvert atom søker etter å ha det ytterste skallet «fylt opp», det vil si at det ønsker å ha åtte elektroner i det ytterste skallet, eller to, om det kun er ett skall. (åtteregelen) ønsker atomene å fylle sitt ytterste skall. Dette kan de gjøre ved å avgi, ta opp eller dele elektroner.
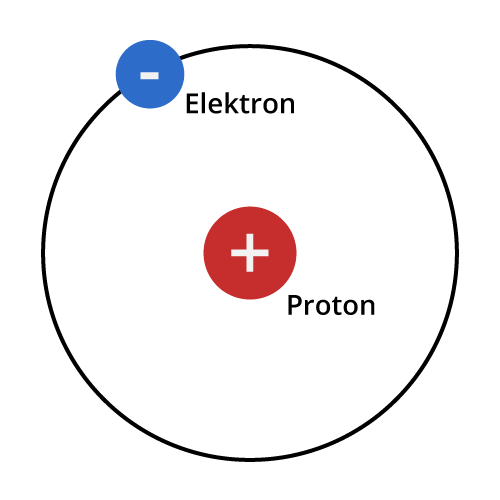
Illustrasjon: UngEnergi
Hydrogen er det vanligste grunnstoffet i universet og har atomnummer 1. Et hydrogenatom har kun ett skall, med ett elektron. For å fylle opp sitt ytterste skall, ønsker det derfor å slå seg sammen med et annet atom. På grunn av dette er stoffet svært reaktivt. Når hydrogen reagerer og binder seg til andre atomer frigjøres energi. Energien til hydrogen ligger altså i denne tendensen til å reagere med andre atomer.
Stort sett har hydrogen allerede bundet seg til et annet stoff i naturen, og det finnes derfor ikke fritt hydrogen på jorda eller i atmosfæren vi kan bruke til energiproduksjon. Derfor sier vi at vi må fremstille hydrogen. Denne prosessen krever tilførsel av energi, og kan for eksempel gjøres gjennom elektrolyseElektrolyse er en kjemisk metode der vi bruker likestrøm til å framstille grunnstoffer i fri tilstand fra kjemiske forbindelser. Når man lader opp et batteri bruker man elektrolyse. I en brenselcelle går prosessene motsatt vei. eller dampreformering. Dette kommer vi tilbake til senere i teksten.
Grunnen til at man ser på hydrogen som en miljøvennlig energibærer, er at både produksjonen og bruken av hydrogen kan være utslippsfri.
Fremstilling av hydrogen ved elektrolyse av vann
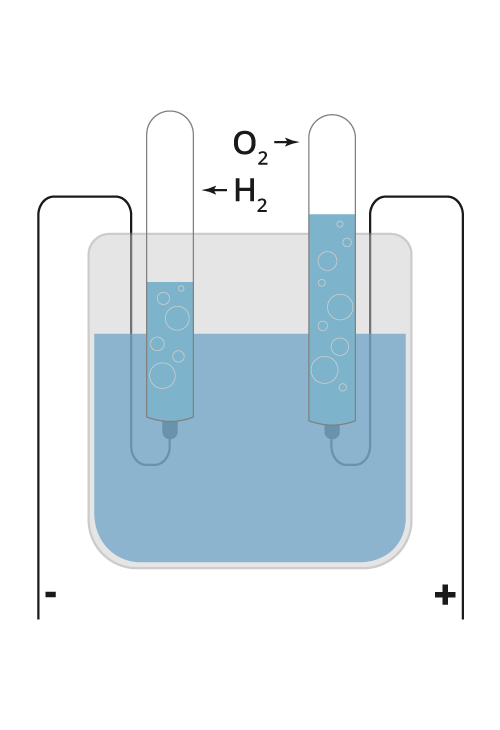
Illustrasjon: UngEnergi
En metode å fremstille hydrogen på, er gjennom elektrolyseElektrolyse er en kjemisk metode der vi bruker likestrøm til å framstille grunnstoffer i fri tilstand fra kjemiske forbindelser. Når man lader opp et batteri bruker man elektrolyse. I en brenselcelle går prosessene motsatt vei. av vann . Elektrolyse går ut på å omdanne elektrisk energi til kjemisk energiEnergi som finnes i bindingene mellom atomene i et stoff, og som blir frigitt ved fullstendig forbrenning. Eksempler er bensin og mat. Dessuten kan batterier omforme kjemisk energi til elektrisk energi., det motsatte av det som skjer spontant i galvaniske cellerEt batteri består av en eller flere galvaniske celler (også kalt galvanisk element). I hver celle blir energi frigitt ved kjemiske reaksjoner. Denne energien kan vi benytte oss av i et batteri. Et galvanisk element består av de fundamentale byggesteinene i et batteri: en anode (et metall eller en kjemisk forbindelse), en katode (et annet metall eller kjemisk forbindelse), en elektrolytt (en væske som leder ioner) og en separator/saltbro (som sørger for at anoden og katoden ikke rører hverandre)., eksempelvis batterier.
Ved elektrolyse av vann bruker man elektrisk energi til å spalte vann til hydrogen og oksygen. Denne energien kan vi få tilbake hvis vi lar hydrogenet og oksygenet reagere og danne vann igjen. Elektrolysen kan beskrives med denne enkle reaksjonslikningen:
\({\text{elektrisk energi} + \text{vann} \enspace \to \enspace \text{hydrogengass }+ \text{oksygengass}}\)
\({\text{elektrisk energi} + \text{2H}_2\text{O(l)} \enspace \to \enspace \text{2H}_2\text{(g)} + \text{O}_2\text{(g)}}\)
Her markerer “(l)” og “(g)” hvilken aggregattilstandDe ulike tilstandene et stoff kan være i. Når vi skriver (s), (l) eller (g) i kjemiske formler, refererer vi til aggregattilstanden til stoffet, som er henholdsvis fast, flytende eller gass. stoffene er i.
Hvis den elektriske energien kommer fra fornybare kilder, er denne måten å fremstille hydrogen på regnet som miljøvennlig og utslippsfri. Hydrogen som produseres på denne måten kaller vi «grønn hydrogen».
Fremstilling av hydrogen med fossile energikilder
Hydrogen fremstilles i dag hovedsakelig fra naturgass gjennom en prosess som kalles dampreformering. Per i dag, er dette den vanligste metoden å fremstille hydrogen. Her reagerer metangass og vanndamp under høyt trykk og høy temperatur, og danner hydrogengass og karbondioksid. Dette kan beskrives med den forenklede reaksjonslikningen nedenfor:
\({\text{metangass } + \text{vanndamp } \enspace \to \enspace \text{hydrogengass } + \text{karbondioksidgass}}\)
\({\text{CH}_4\text{(g)} + \text{2H}_2\text{O(g)} \enspace \to \enspace \text{4H}_2\text{(g)} + \text{CO}_2\text{(g)}}\)
Som du ser, er klimagassen \(\text{CO}_2\) et sluttprodukt i reaksjonen. Når det kommer til spørsmål om denne prosessen er miljøvennlig eller ikke må man se på hva som gjøres med \(\text{CO}_2\)-en etterpå. Slippes den ut i atmosfæren vil ikke en slik fremstillingen av hydrogen føre til reduserte klimagassutslipp. Likevel er det mulig å lagre \(\text{CO}_2\) i berggrunnen slik at gassen ikke slipper ut i atmosfæren. Med dagens teknologi kan omtrent 90% av \(\text{CO}_2\)-en fanges. Denne måten å fremstille hydrogen og deretter lagre \(\text{CO}_2\)-en, kaller vi «blå hydrogen».
Oppsummering
Vi konkluderer med å svare på spørsmålene vi stilte i innledningen. Det er et ønske om å bruke hydrogen som energibærer fordi hydrogen er universets mest vanlige grunnstoff, og det har lett for å reagere med oksygen til energi og vann. Men for å kunne bruke hydrogen som energibærer, må vi framstille det. Dette kan gjøres uten klimagassutslipp, for eksempel gjennom elektrolyseElektrolyse er en kjemisk metode der vi bruker likestrøm til å framstille grunnstoffer i fri tilstand fra kjemiske forbindelser. Når man lader opp et batteri bruker man elektrolyse. I en brenselcelle går prosessene motsatt vei. av vann og dampreformering av metan.
Hvis du ønsker å lære mer om hvordan man lagrer og bruker hydrogenet etter å ha fremstilt det, kan du sjekke ut vår tekst om dette her. Er du interessert i å lære om hydrogenbilen, kan du lese mer her (UngEnergi.no).
Forsøk: Elektrolyse av vann
Film: Universitetet i Bergen

 Denne artikkelen skrevet av UngEnergi er lisensiert under en
Denne artikkelen skrevet av UngEnergi er lisensiert under en