
Du hører på musikk og tekster med mobilen mens du sitter i en elektrisk bil. Ingen av disse apparatene er koblet med ledning til strømnettet, men likevel går alle aktivitetene på elektrisk energi. Hvordan er dette mulig?
Dette er takket være batteriet. I et batteri lagres det kjemisk energi som man kan hente ut når man trenger den. Den kjemiske energien blir frigitt i reaksjoner mellom stoffene inne i batteriet. Resultatet er elektrisk energi som kan drive de bærbare apparatene våre.
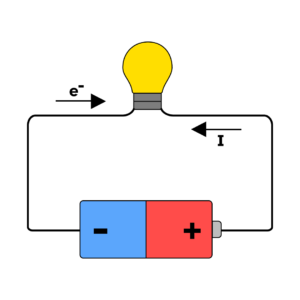
Et batteri består av en anode og en katode som er nedsenket i en elektrolytt. Når batteriet er i bruk går elektroner fra anoden til katoden gjennom en ytre krets, og det er dette som gir oss strøm. I oppladbare batterier går elektronene fra katoden og tilbake til anoden igjen ved opplading, og da er batteriet klart til å bli brukt på nytt. Vi skiller mellom ulike typer batterier, både basert på om de er oppladbare eller ikke, hva slags formfaktor de har og deres kjemiske sammensetning.
Batterier har potensial til å være en nyttig miljøteknologi. De kan for eksempel brukes til å produsere elbiler, som er et mer klimavennlig alternativ til tradisjonelle fossilbiler. Batterier kan også brukes til å lagre overskuddsstrøm fra fornybar energi. Dette vil gjøre samfunnet mindre avhengig av fossile energikilder, og på den måten bidra til det grønne skiftet.
Batterier inneholder noen stoffer som kan ha en negativ påvirkning på miljøet og klimaet når de utvinnes. Derfor er det viktig å resirkulere batterier for å begrense utvinningen av nye ressurser i størst mulig grad. Samtidig forskes det på muligheten for å ta i bruk andre materialer som har mindre konsekvenser for klimaet og er billigere. Annen forskning fokuserer på å gjøre batteriene tryggere og mer energitette.
Hvordan fungerer et batteri?
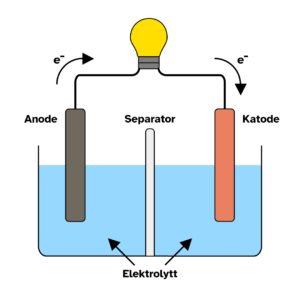
Et batteri er bygget opp av én eller flere galvaniske celler. Hver galvaniske celle består av en anode, en katode, en elektrolytt og enten en saltbro eller en separator. Når et batteri lades ut (brukes for å gi strøm til et apparat) vil elektroner bevege seg fra anoden til katoden gjennom en ytre krets. Dette skjer fordi anoden er laget av et materiale som gjerne vil gi fra seg elektroner, mens katoden gjerne vil motta elektroner. Denne bevegelsen av elektroner gjennom en krets er det som gir oss strøm.
Elektrolytten i den galvaniske cellen er en væske eller gelé som kun leder ionerEt atom som har fått eller gitt fra seg elektroner. Et ion har derfor en positiv eller negativ elektrisk ladning.. Elektrolytten er plassert mellom anoden og katoden, og kan for eksempel være en saltløsning. Det er viktig at den ikke leder elektroner fordi man ønsker at de skal gå gjennom den ytre kretsen. Det er derimot ønskelig at den kan lede ioner, ettersom dette er viktig for å opprettholde elektrisk nøytralitet i systemet. Uten flyt av ioner gjennom elektrolytten ville ladningen i den galvaniske cellen etterhvert blitt skjevfordelt. Den siden med et overskudd av elektroner ville blitt svært negativt ladet, og siden med et underskudd av elektroner ville blitt positivt ladet. Dette ville ført til at strømmen etterhvert stoppet opp. For å unngå dette har man flyt av ioner i elektrolytten som kan balansere den elektriske ladningen i systemet. I tillegg ønsker man ikke at anoden og katoden skal røre hverandre, ettersom dette ville ført til kortslutningOppstår når strømmen finner en enklere vei å gå, og unngår den vanlige kretsen.. Derfor tar man i bruk en saltbro eller en separator.
En saltbro fungerer som en bro mellom de to sidene av den galvaniske cellen, og tillater fri flyt av ioner i systemet. Her vil både positivt og negativt ladede ioner i elektrolytten transporteres frem og tilbake for å balansere ladningen i cellen. En separator fungerer som en delvis gjennomtrengelig vegg som er nedsenket i elektrolytten. Den er laget av et porøst materialeEt materiale med porer, små åpninger og hulrom i seg. som tillater passasje av ioner samtidig som den forhindrer at anoden og katoden rører hverandre. Saltbroen og separatoren fyller dermed samme funksjon, men på litt ulike måter. I moderne batterier brukes det så og si alltid en separator, mens en saltbro kan brukes i eksperimentelle batterier på lab.
Når batteriet lades ut transporteres altså elektroner fra anoden til katoden gjennom en ytre krets, mens positivt og negativt ladede ioner i elektrolytten transporteres frem og tilbake for å balansere ladningen i systemet. Når et batteri lades opp skjer den samme reaksjonen, men motsatt vei. Batteriet påføres nå en strøm som tvinger elektronene til å gå fra katoden og tilbake til anoden. Samtidig vil ioner transporteres gjennom elektrolytten for å opprettholde elektrisk nøytralitet. Reaksjonene som skjer i et batteri kalles redoksreaksjonerReaksjoner der et stoff blir redusert (blir mer negativt ladet), og et annet stoff blir oksidert (blir mer positivt ladet). Ved utlading av et batteri vil anoden oksideres fordi den gir fra seg elektroner, og katoden reduseres fordi den mottar elektroner., og er en av de viktigste kjemiske reaksjonene vi vet om.
Ulike typer batterier
Det finnes mange ulike typer batterier, men det er vanlig å skille mellom to hovedtyper: Primærbatterier og sekundærbatterier. Primærbatterier er ikke oppladbare, og kan dermed kun brukes én gang. Slike batterier finner du gjerne i fjernkontrollen eller brannvarsleren din hjemme. Siden disse ikke er oppladbare må de byttes ut når de er tomme. Sekundærbatterier er derimot oppladbare, og er derfor vanlig i mange bærbare apparater som mobiltelefoner og nettbrett.
Batterier kan ha flere ulike formfaktorerEt produkt sin form og størrelse.. Noen vanlige formfaktorer er sylindriske celler, prismatiske celler, poseceller og knappceller. Hva slags type som brukes i et bestemt apparat avhenger av designet og plassen i produktet.

Selv om de fleste batterier bygger på samme prinsipp kan den spesifikke teknologien som brukes variere. Batterier kan ha ulike materialer og kjemikalier i seg, og derfor er det også vanlig å skille på dem avhengig av hva slags kjemisk sammensetning de har. Her kommer noen eksempler på ulike batteriteknologier:
- Litium-ionbatterier er batterier der litium-ioner ledes gjennom elektrolytten. Dette er den vanligste batteriteknologien som brukes i dag. Batterier av denne typen er populære fordi de kan lagre mye energi i en relativt liten og lett formfaktor. Vi sier da at de har høy energitetthetMengden energi som kan lagres per volum eller vekt.. Man finner gjerne litium-ionbatterier i mobiltelefoner, bærbare datamaskiner og elbiler.
Les mer om litium-ionbatterier her (UngEnergi.no).
- Blybatterier er blant de første batteriteknologiene som ble oppfunnet, og brukes fremdeles mye i dag. De brukes blant annet som startbatteri i biler (altså ikke det store oppladbare batteriet du finner i en elbil, men det batteriet som setter i gang de mekaniske prosessene i en bil).
- Nikkel-metallhydridbatterier er mindre brukt i dag da de i stor grad har blitt utkonkurrert av litium-ionbatterier. Likevel kan man fremdeles finne dem i noen produkter, som for eksempel i Toyota sine hybridbiler.
Batteri som miljøteknologi
Bruk av batterier blir ofte omtalt som en viktig del av det grønne skiftetOmstillingen til et mer miljø- og klimavennlig samfunn.. En av grunnene til dette er at batterier har potensial til å erstatte bruk av fossile brensler i visse sektorer, som for eksempel transportsektoren. Veitransport står for ca. 12% av verdens klimagassutslipp. Å få biler til å gå fra å bruke fossilt drivstoff til å gå på fornybar strøm vil derfor utgjøre en enorm forskjell. For å få til dette trenger man batterier. I de seneste årene har elbiler hatt en enorm teknologisk utvikling, og de har samtidig blitt mye mer populære. I 2022 var 8 av 10 nye biler som blir solgt i Norge elbiler, og dette bidrar til det grønne skiftet. For å møte det økende behovet for batterier satser flere organisasjoner på batteriproduksjon, deriblant mange norske bedrifter.
Les mer om Norges satsning på batterier her (UngEnergi.no).

Batterier kan også gjøre overgangen fra fossil- til fornybar energiproduksjon enklere. Produksjon av energi er den klart største kilden til klimagassutslipp i verden i dag. Et skifte til fornybar energi er dermed essensielt for å få ned globale utslipp, men en ulempe er at det kan variere når disse energikildene er tilgjengelige. Solceller produserer kun energi når sola skinner, vindturbiner produserer kun når det blåser og vannkraftverk er avhengig av at det regner jevnlig. Dette betyr at man til tider kan få et underskudd av energi, mens man andre ganger produserer mer energi enn man trenger. En løsning på dette problemet er å lagre energi i batterier i de periodene man har høy energiproduksjon, og så bruke denne energien når produksjonen er lavere. Victorian Big Battery er et eksempel på en såkalt batteripark der man har enorme batterier som kan lagre store mengder energi. Den befinner seg i Australia, og har en lagringskapasitet på 450 MWh. Det er nok energi til å forsyne over én million hus i en halvtime, eller ett hus i 57 år.
En ulempe med å bruke batterier til energilagring er at man taper noe energi under lagringsprosessen. Både ved opplading og utlading vil noe av energien gå tapt, blant annet i form av varme. EffektivitetenAndelen energi som blir brukt til å utføre det ønskede arbeidet. til et litium-ionbatteri ligger et sted mellom 85 og 98%, avhengig av ulike faktorer som for eksempel temperatur. Det vil si at 2-15% av energien som blir produsert vil gå tapt når den mellomlagres i batterier. Likevel er denne effektiviteten nokså god sammenlignet med andre energilagringsteknologier som for eksempel hydrogen og pumpekraft. Det aller beste er å bruke energien når den faktisk produseres, men når det er ønskelig å lagre store mengder energi fremstår batterier som et godt alternativ. Samtidig er det verdt å nevne at ulike lagringsteknologier har ulike fordeler og ulemper, så batterier vil ikke alltid være den beste løsningen.
Les mer om energilagring her (UngEnergi.no).
Miljøkonsekvenser

Batterier består av metaller som litium, kobolt og nikkel. Disse må utvinnes gjennom gruvedrift, noe som er en energikrevende prosess og fører til utslipp av CO2. I tillegg kan gruvedrift føre til forurensning som påvirker lokalmiljøet. Det kan forstyrre ellers uberørt natur, og i verste fall føre til vannforurensning og avskoging. Likevel er ikke gruvedrift unikt for batteriproduksjon. Ulike metaller brukes i en rekke produkter, og dette må enten komme direkte fra gruvedrift eller fra resirkulerte produkter.
Det er spesielt viktig at batterier resirkuleres da de kan inneholde miljøskadelige stoffer som man ikke ønsker at skal havne i naturen. I tillegg kan batterier være en brannfare dersom de kastes i restavfall. Generelt sett er det også ønskelig med resirkulering for å begrense utvinning av nye ressurser. Batterier kommer til å bli brukt mer og mer i årene som kommer, og man er avhengig av å ha god tilgang på materialene som kreves for å produsere dem. Ved å gjenvinne disse materialene vil man ikke trenge å utvinne like mye nytt.
Til tross for at batterier har noen negative miljøkonsekvenser må disse også veies opp mot de positive konsekvensene. Som nevnt tidligere har batterier blant annet potensial til å erstatte bruk av fossile brensler – som har en enda større negativ påvirkning på miljøet og klimaet. Ved å resirkulere batteriene vil også de verste miljøpåvirkningene kunne reduseres.
Forskning på nye typer batterier
Ettersom batterier vil spille en viktig rolle i fremtiden forskes det mye på hvordan de kan gjøres enda bedre. Nøyaktig hva som gjør et batteri bedre kommer an på hva du skal bruke det til. Energitetthet, ladehastighet, levetid, pris og sikkerhet er noen av faktorene som må tas hensyn til. Hvis man skal bruke batterier i en batteripark vil noe av målet være å lagre så mye energi som mulig på en trygg og billig måte. Det forskes derfor på hvordan man kan bytte ut visse materialer i et batteri med billigere og mer tilgjengelige alternativer. Om man også klarer å erstatte materialene som har størst miljøpåvirkning vil batteriene kunne produseres mer miljøvennlig.
Hvis man på en annen side skal bruke batteriet i en mobiltelefon eller elbil vil høy energitetthet være en prioritet. For å forbedre dette forskes det blant annet på en ny teknologi som kalles faststoffbatterier. Prinsippet her er at man erstatter den flytende elektrolytten i batteriet med et fast stoff. Problemet med en flytende elektrolytt er nemlig at det er en sikkerhetsrisiko. Om den kommer i kontakt med luft vil den ta fyr, og for å unngå dette pakker man batteriene godt inn i ekstra materiale som krever plass. Hvis man klarer å erstatte elektrolytten med et fast stoff vil man ikke lenger ha behov for disse ekstra sikkerhetskomponentene. Dette vil frigjøre plass, og gi batteriet en høyere energitetthet samtidig som det blir tryggere. Faststoffbatterier vil trolig være i nye elbiler om få år, og det vil gi bilene enda lenger rekkevidde.

 Denne artikkelen skrevet av UngEnergi er lisensiert under en
Denne artikkelen skrevet av UngEnergi er lisensiert under en