På nettsiden vår presenteres det ofte konsepter som involverer temperatur, varme og trykk. For å kunne forstå mye av det innholdet som dreier seg om utnyttelse av varmeenergi, er det viktig å ha et forhold til begrepene varme og temperatur, samt å kunne skille mellom dem og bruke dem presist i fysikksammenheng. Læren om de mekanismene som ligger til grunn for disse prosessene kaller vi termodynamikk.
Temperatur
Temperatur er et begrep som kan være vanskelig å definere helt presist. Vi har alle et forhold til temperatur – typisk klarer vi å skille mellom to legemer med forskjellig temperatur. Dette har likevel sine svakheter ettersom sansene våre kan bedra oss. Men, mange materialer vi finner i naturen har egenskaper som endrer seg når temperaturen endres, og dette har blitt utgangspunktet for å gjøre temperatur til en målbar størrelse gjennom at vi har utviklet termometre. Disse innretningene har gjort oss i stand til å kunne si sikkert om to legemer har lik eller ulik temperatur. Når to legemer har lik temperatur er de i termisk likevekt – dette kan vi bruke til å forklare nærmere hva temperatur faktisk er.
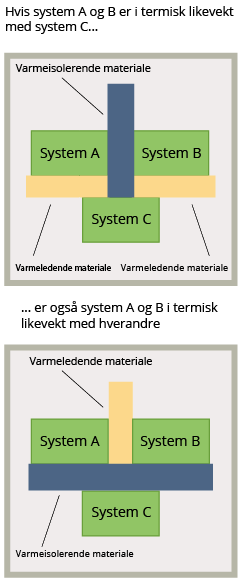
La oss betrakte tre systemer; A, B og C som i utgangspunktet ikke har lik temperatur. Dersom vi isolerer system A fra system B, men lar system C være i kontakt med både A og B, har vi et oppsett slik vist øverst i figur 1. De systemene som er i kontakt med hverandre vil etter hvert oppnå termisk likevekt. Dette vil altså si at system A er i termisk likevekt med C, og system B også er i termisk likevekt med C. For å nå undersøke om system A er i termisk likevekt med system B fjerner vi det isolerende materialet mellom A og B, se nederst på figur 1. Undersøkelser viser at ingenting skjer med temperaturen i de to systemene – og vi kan derfor konkludere med at også A og B er i likevekt.
Det å definere temperatur på denne måten er likevel ganske ufullstendig, og gir oss muligens ikke så mye før vi har presentert termodynamikkens 2. lov. Vi snakker ofte om at temperatur er et mål på den indre kinetiske energien i et stoff, altså dreier temperaturen seg om tilfeldige og uordnede bevegelser til de partiklene som utgjør et stoff. Atomer og molekyler beveger seg alltid i forhold til hverandre, enten om stoffet de utgjør er flytende, fast eller i gassform. Disse bevegelsene kaller vi termiske bevegelser, og vi skiller mellom tre former; rotasjons-, vibrasjons- og translasjonsbevegelseRettlinjet bevegelse. Dersom en av disse bevegelsestypene øker, øker den kinetiske energienBevegelsesenergi: Ethvert legeme i bevegelse har bevegelsesenergi. Energimengden er bestemt av massen og farten til legemet etter formelen Ek = ½mv². og følgelig også temperaturen.
Men, temperatur i seg selv som størrelse betyr ingenting om man ikke angir et referansepunkt, det vil si et punkt (en bestemt temperatur) man måler i forhold til. Hvor skal så dette referansepunktet settes? Kelvinskalaen (måles i Kelvin, K) er en såkalt absolutt temperaturskala. Det absolutte nullpunkt er der hvor den indre energi er på sitt aller laveste. Kelvinskalaen har for øvrig samme trinnstigning som celsiusskalaen, som vil si at temperaturforskjellen mellom to grader Celsius er lik temperaturforskjellen mellom to grader Kelvin.
Varme og termodynamikkens 2. lov
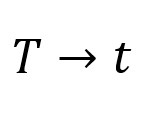
Varme og temperatur brukes i dagligtale om hverandre, men i fysikken er det helt avgjørende å kunne skille mellom dem. Varme er energi som blir overført fra ett sted til et annet på grunn av en temperaturforskjell. I tillegg til definisjonen av varme er termodynamikkens 2. lov nyttig i denne sammenhengen – varme kan ikke gå av seg selv fra et system med lav temperatur til et system med høy temperatur. To systemer ønsker altså alltid å oppnå termisk likevekt. Av denne loven ser vi at dersom det ikke er en temperaturforskjell mellom to legemer i kontakt med hverandre vil det ikke overføres varme – ingenting skjer med temperaturen, altså er de i termisk likevekt. Dette vises også ved eksempelet i figur 1.
Termodynamikkens 1. lov
Trykk

Vi studerer en gass i en lukket beholder, se figur 3. Her vil det virke en kraft fra hvert molekyl på veggen i beholderen, ettersom molekylene alltid er i bevegelse og dulter borti veggene til stadighet. Summen av alle kreftene som virker på veggen i beholderen fra molekylene i væsken utgjør trykket i beholderen, og det bestemmes av antall molekyler og deres fart
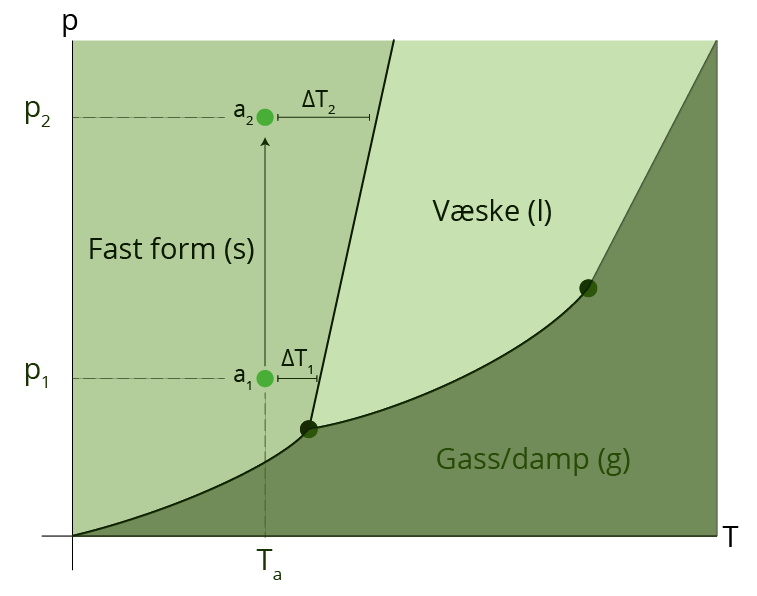
Diagrammet i figur 4 viser sammenhengen mellom temperatur \(T\) og trykk \(p\) for stoffer som endrer fase. Vann kan for eksempel endre fase og bli fast (is), flytende (vann), eller gass (damp). La oss si at vi har et stoff i punkt \(a_1\) – dette stoffet er i fast form. For å få en faseovergang til væske må vi øke temperaturen med \(\Delta T_1 \), forutsatt at trykket er konstant. Dersom vi istedenfor øker trykket til dette stoffet og samtidig holder temperaturen konstant vil dette stoffet ta plass langs den grønne linja, til punkt \(a_2\). Hvis vi nå skulle fått en faseovergang til væske (med konstant trykk) måtte vi økt temperaturen med \(\Delta T_2 \). Vi ser av diagrammet at \( \Delta T_2 > \Delta T_1 \). Dette viser oss at smeltepunktene for samme legeme ved to ulike trykk ikke er like – det samme gjelder kokepunktene og frysepunktene. Temperaturen og trykket er altså kun avhengige ved faseoverganger. Dette vil si at man ved å øke trykket i vann øker kokepunktet og at man ved å senke trykket vil senke kokepunktet.

 Denne artikkelen skrevet av UngEnergi er lisensiert under en
Denne artikkelen skrevet av UngEnergi er lisensiert under en